Raio Atômico
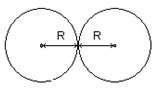
O raio atômico é uma das propriedades periódicas dos elementos químicos, e representa a distância entre o centro do núcleo de um átomo e a camada mais externa da eletrosfera (camada de valência).
É calculado a partir de uma molécula diatômica de um mesmo elemento
como a metade da distância entre os respectivos núcleos. Pois, como o
átomo não é uma esfera, o cálculo do raio quando isolado é
demasiadamente impreciso.
Geralmente, o raio atômico cresce conforme aumenta o número de camadas e diminui com o aumento do número atômico. Assim, numa mesma família, o raio aumenta de cima para baixo. E, no mesmo período, da direita para a esquerda.
O raio atômico está, também, intrinsecamente ligado à propriedade periódica da eletronegatividade. Pois, quanto maior essa propriedade, com maior força o núcleo atrai a eletrosfera e menor é o raio.
De forma análoga, quanto maior o raio atômico, menor o potencial de ionização – já que a eletrosfera não é tão fortemente atraída pelo núcleo e o elétron de valência pode ser removido com mais facilidade; e menor a afinidade eletrônica – pois, com menos força de atração sobre a eletrosfera, uma menor quantidade de energia é liberada ao recebimento de um elétron.
Fontes:
http://pt.wikipedia.org/wiki/Raio_atómico